治験総括報告書の翻訳を効率化するには?
ヒューマンサイエンスのブログサイトでは、ChatGPTなどの翻訳への活用についての記事を多く掲載し定評をいただいております。メディカル翻訳についても幅広いブログを掲載しています。ここでは、「治験総括報告書(CSR)」に焦点を当ててご紹介します。

- 目次
-
- 1.治験総括報告書とは?
- 1-1.治験とは?治験を迅速に進めることの意義は?
- 1-2.様々な治験文書における治験総括報告書の位置づけは?
- 1-3.治験総括報告書の構成
- 2.治験総括報告書作成にまつわる課題
- 2-1.作成に労力がかかる
- 2-2.翻訳を大量かつ迅速にしなければならない
- 3.治験総括報告書を翻訳するときの注意点
- 3-1.専門用語の正確性、規制要件・治験に関するガイドラインの遵守、用語の一貫性、表現の明確さが必要
- 3-2.有害事象名や薬剤などの訳には注意が必要
- 4.治験総括報告書の翻訳を効率化するには?
- 4-1.治験総括報告書翻訳は誰に依頼する?
- 4-2.機械翻訳、AIによる効率アップを提供する翻訳会社も
- 5.治験総括報告書翻訳のご相談はヒューマンサイエンスへ
1. 治験総括報告書とは?

1-1. 治験とは?治験を迅速に進めることの意義は?
治験とは、ヒトを対象に行う臨床試験の中でも、とりわけ、新薬承認申請を目的とした試験のことを指し、新薬の有効性・安全性を評価します。
治験は、製薬会社が治験依頼者、任命された医師が治験責任医師となり、治験実施施設において厳格なプロトコルに基づいて実施され、その結果は治験実施各国の規制当局に提出され、承認のための審査を受けます。
新薬といえば、最近では肥満症薬や認知症治療薬の治験・承認の行方が、医療ニュースのみならず経済ニュースとなっています。
これらの新薬の承認がスムーズに進むかどうかは、医療界や患者さんに影響を及ぼすことはいうまでもありませんが、製薬企業の業績や株価へのインパクトもあるため、私たちの社会生活や経済全般への影響は無視できません。
また、海外の医薬品の治験過程で日本人における安全性を別途確認しなければならない制度が原則廃止されるとの報道もありました(2023年11月13日)。これも新薬の早期導入を促すためのものといえます。
治験を迅速に進めることの意義は大きいものがあるのです。
1-2. 様々な治験文書における治験総括報告書の位置づけは?
治験では、様々な種類の文書が発生します。
治験の計画や実施に関する詳細な情報が含まれる治験実施計画書(プロトコル)、治験に使用される医薬品や製品に関する文書で、治験チームや規制当局に対して、治験薬の理解を深める役割を果たす治験薬概要書(IB)、治験薬のリスク、利益、プロトコルの詳細などが記載され、治験に参加する被験者に提供し、彼らが治験に参加する意思を理解し、同意することを確認するための治験同意書(ICF)などが、それに当たります。
治験総括報告書とは、治験の実施結果をまとめた文書のことで、「Clinical Study Report」の略語の「CSR」と呼ばれることも多いです。
治験総括報告書は、治験終了時に作成されます。治験実施計画書と同様、治験の目的や計画等が記載され、GCP遵守関連の陳述、安全性・有効性の評価などが記載されます。
治験総括報告書は、規制当局に提出され、治験の結果に基づいて新しい医薬品や治療法の承認を得るために使用されます。また、学術誌に投稿されることで、医学界や研究者に治験の結果を広く共有されます。
1-3. 治験総括報告書の構成
「治験の総括報告書の構成と内容に関するガイドラインについて」(平成8年5月1日 薬審第335号各都道府県衛生主管部(局)長あて 厚生省薬務局審査課長通知)では、治験総括報告書の構成を以下のように記載し、それぞれの項目について、下位項目やガイドラインを詳細に示しています。
1. 標題ページ
2. 概要
3. 目次
4. 略号及び用語の定義一覧
5. 倫理
6. 治験責任医師等及び治験管理組織
7. 緒言
8. 治験の目的
9. 治験の計画
10. 治験対象患者
11. 有効性の評価
12. 安全性の評価
13. 考察と全般的結論
14. 本文中には含めないが,引用する表,図及びグラフ
15. 引用文献の一覧表
16. 付録
このように、治験全体を網羅した大変幅広い内容となっています。

2. 治験総括報告書作成にまつわる課題

治験総括報告書にまつわるよくある課題を解説します。
2-1. 作成に労力がかかる
治験総括報告書は、本文だけで100ページを超えたり、引用や付録のデータやグラフを含めると数百ページに及んだりすることもある膨大な量の文書です。
治験実施計画書(プロトコル)、統計解析計画書(SAP)、症例報告書(CRF)、SAE(Serious Adverse Event)報告書などのソース文書から相当量の情報を取り込みながら治験総括報告書を作成する必要があります。
治験総括報告書は、治験の最終段階で作成される文書であることもあり、作成に当たっては医学・統計・各種規制等々に関する高度な知識が求められます。製薬会社が社内でリソースを確保するにせよ、外部のライターに協力を依頼するにせよ、膨大かつ高度な内容の文書を定められたフォーマットを遵守して作成する必要があります。
2-2. 翻訳を大量かつ迅速にしなければならない
先述のとおり、治験総括報告書の分量は膨大で内容的にも高度でありながら、作成は迅速に進めることが求められます。
日本国内の治験結果を用いて海外で申請する場合、英文の報告書が求められ、海外の英文報告書を用いて日本で申請する際には、日本語の要約を作成する必要があるため、翻訳においても迅速さが求められます。
3. 治験総括報告書を翻訳するときの注意点
続いて、治験総括報告書を翻訳するときの注意点をお伝えします。
3-1. 専門用語の正確性、規制要件・治験に関するガイドラインの遵守、用語の一貫性、表現の明確さが必要
専門用語の正確性:治験に関連する医学・薬学用語は正確に翻訳することが重要です。特に、薬剤名、有害事象名、治療法、診断基準など、専門的な用語が多く含まれるため、それぞれに適切なデータベースや資料を参照して、誤解を招かないように翻訳します。
規制要件・治験に関するガイドラインの遵守:治験総括報告書は規制当局(FDA、EMA、日本のPMDAなど)に提出されるものであるため、各国の規制要件・治験に関連する国際的なガイドライン(ICH-GCPなど)に合わせることが必要です。国によって要求される報告書の形式や記載内容に差異がある場合があるため、それに対応した翻訳が求められます。
用語の一貫性:報告書の中で使用される用語やフレーズが一貫していることが大切です。特に、治験のキーとなる用語(患者、被験者、治療群、対照群など)や治験対象薬剤における主要な専門用語は翻訳全体で統一されている必要があります。
表現の明確さ:治験結果や試験方法についての説明は、誤解を招かないように明確で簡潔に翻訳する必要があります。特にデータや統計分析に関する部分では、正確な数字や結果を適切に伝えることが求められます。
3-2. 有害事象名や薬剤などの訳には注意が必要
上記の注意点の具体例として、「有害事象名」と「薬剤名」を例にとってご説明します。
薬剤投与後に生じる「有害事象名」は、国際的な医学用語体系のMedDRA(Medical Dictionary for Regulatory Activities)に準じた名称で記載する必要があります。
また、薬剤の名称には「化学名」、「一般名」、「販売名」があります。アスピリンを例にとると、「化学名(化学構造を表す)」は「2-acetoxybenzoic acid」で、「一般名(有効成分を表す)」と「販売名」はどちらも「アスピリン」です(ちなみにアスピリンを成分に含む市販薬にバファリンなどがあります)。
基本的には、適切なデータベース・資料を参照したうえで原文に則した訳にすれば問題ないはずですが、MedDRAの位置づけや薬剤名の違いについては理解して正しく翻訳する必要があるでしょう。
4. 治験総括報告書の翻訳を効率化するには?

4-1. 治験総括報告書翻訳は誰に依頼する?
治験総括報告書翻訳の依頼先は、医療や医薬、治験などに関する翻訳の実績のある翻訳会社、高い専門知識と経験を持つ翻訳者を擁する翻訳会社がよいでしょう。
4-2. 機械翻訳、AIによる効率アップを提供する翻訳会社も
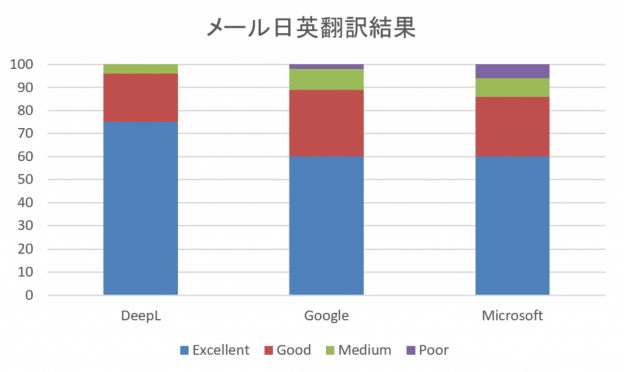
治験総括報告書の翻訳は、専門性だけでなく、迅速性やコストも重視されます。
「機械翻訳」や、既存の翻訳を翻訳メモリにして過去の文書を活用する「翻訳支援ツール」による翻訳の効率化、ChatGPTなどのAIやチェックツールなどによる翻訳周辺作業の効率化が強みの翻訳会社も存在します。
治験総括報告書の翻訳は、そういった強みのある翻訳会社に依頼するのがよいでしょう。

5. 治験総括報告書翻訳のご相談はヒューマンサイエンスへ

ヒューマンサイエンスは、医療・メディカル全般の翻訳を手掛ける翻訳会社であると同時に、翻訳関連の各種テクノロジーを開発・運用するドキュメントテクノロジーカンパニーであり、その実力は、幅広い大手IT企業やメーカ等における豊富な実績に裏打ちされています。
メディカル翻訳の特長|ヒューマンサイエンス
今回紹介した治験総括報告書をはじめ、治験実施計画書、CIOMS、治験同意書などの治験文書の実績があります。
メディカル 医薬・医療翻訳サービス|ヒューマンサイエンス
機械翻訳や翻訳支援ツールを用いた翻訳の効率アップ、品質の向上も得意とするヒューマンサイエンスに、ぜひお任せください。
メディカル翻訳の豊富な実績|ヒューマンサイエンス